Ny anbefaling fra helseforetakene
Fra 1. september 2024 kan du bruke Fasenra (benralizumab) som førstevalg og Tezspire (tezepelumab) som andrevalg ved behandling av alvorlig astma hos voksne.5

Alvorlig astma
Lær mer om immunologi, patogenese, klinikk og biologiske behandlinger
Alvorlig astma er en kompleks og sammensatt sykdom, med flere genotyper, fenotyper, sykdomsdrivere og kliniske presentasjoner.1-4 Da kan man spørre seg om det kan utfordre behandleres muligheter til å ta kunnskapsbaserte og gode valg? På denne siden finner du informasjon om underliggende sykdomsprosesser, biomarkører, mulige pasientprofiler og biologiske behandlinger.

Pasienter med restsymptomer, flere inflammasjondrivere og lave nivåer av eosinofiler kan ha klinisk nytte av blokkering lenger opp i signalveien.6-9
Pasientprofiler
De fleste med alvorlig astma har fenotypen alvorlig eosinofil astma10, og mange kan ha effekt av Fasenra11-15.
Pasientprofiler
Epitelcytokinet TSLP spiller en sentral rolle i inflammasjonsprosessene ved alvorlig astma.6-9
Les mer eller se video med Lena Uller
Alvorlig astma kan være krevende å behandle.1-3,6 Studier viser at mange pasienter har flere drivere av inflammasjon.4
Les mer eller se video med Sigrid Vikjord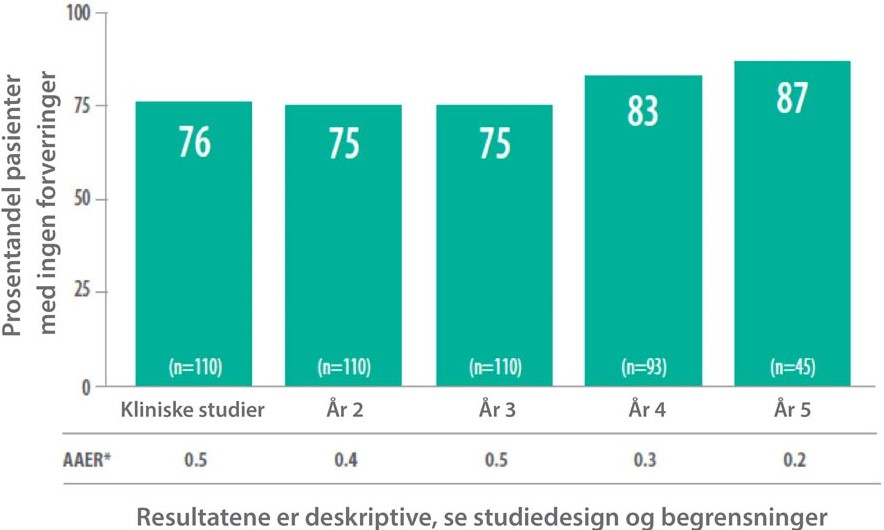
Opprettholder reduksjon i forverringer etter 5 år11, og reduserer bruk av orale kortikosteroider12-14...
Se studiedata
Reduserer forverringer, og bedrer lungefunksjon og astmakontroll, på tvers av fenotyper og biomarkører6-7,18...
Se studiedata
Fasenra doseres hver 8. uke, etter oppstartsperiode. Kan settes av pasienten selv eller helsepersonell19...
Se praktisk informasjonFasenra er indisert som tillegg til vedlikeholdsbehandling hos voksne med alvorlig eosinofil astma som er utilstrekkelig kontrollert til tross for høye doser inhalasjonskortikosteroider samt langtidsvirkende betaagonister.
Feber, reaksjon på injeksjonsstedet, overfølsomhetsreaksjon, faryngitt, hodepine. Skal ikke brukes til å behandle akutte astmaeksaserbasjoner.
Tezspire er indisert som tillegg til vedlikeholdsbehandling ved alvorlig astma som er utilstrekkelig kontrollert til tross for høye doser inhalasjonskortikosteroider i tillegg til et annet legemiddel for vedlikeholdsbehandling.
Vanlige bivirkninger er faryngitt, utslett, artralgi og reaksjon på injeksjonsstedet. Medikamentet skal ikke brukes til å behandle akutte astmaeksaserbasjoner.

Elevating patient care by advancing science and education on the epithelium as an immune-functioning organ, central to disease pathogenesis and remission.
Gjør som mange andre spesialister: Få informasjon om utdanninger, medisinske nyheter, pasientstøtte, stipendier og annen nyttig informasjon som kan gjøre arbeidet ditt enklere - tilpasset fagområde og interesser.
Du kan når som helst trekke tilbake ditt samtykke ved å benytte en link som finnes i all vår kommunikasjon til deg.
Indikasjon: Tezspire er indisert som tillegg til vedlikeholdsbehandling hos voksne og ungdom i alderen 12 år og eldre med alvorlig astma som er utilstrekkelig kontrollert til tross for høye doser inhalasjonskortikosteroider i tillegg til et annet legemiddel for vedlikeholdsbehandling.
Dosering: Anbefalt dose: 210 mg s.c. hver 4. uke. Tezspire er til langtidsbehandling. Minst 1 gang årlig bør det vurderes om behandlingen skal fortsette, basert på nivået av astmakontroll. Ved glemt dose, skal denne administreres så fort som mulig. Deretter kan doseringen gjenopptas på neste planlagte administrasjonsdag. Dersom det allerede er tid for neste dose, skal den administreres som planlagt. Dobbel dose skal ikke administreres. Behandling skal initieres av lege med erfaring med diagnostisering og behandling av alvorlig astma.
Vanlige bivirkninger: Faryngitt, utslett, artralgi, reaksjon på injeksjonsstedet.
Forsiktighetsregler: Skal ikke brukes til å behandle akutte astmaeksaserbasjoner. Astmarelaterte symptomer eller eksaserbasjoner kan oppstå. Pasienten bør instrueres om å oppsøke lege hvis astmaen forblir ukontrollert eller forverres. Brå seponering av kortikosteroider etter behandlingsoppstart anbefales ikke. Eventuell dosereduksjon av kortikosteroid bør skje gradvis under legeoppsyn. Overfølsomhetsreaksjon/anafylaksi kan oppstå innen noen timer, men også noen dager, etter administrering. Anamnese med anafylaksi (ikke relatert til Tezspire ) kan være en risikofaktor.Pasienter skal overvåkes i passende tid etter administrering. Alvorlige infeksjoner bør behandles før oppstart av behandling. Ved utvikling av alvorlig infeksjon under behandling, bør behandlingen seponeres inntil denne er over. Pasienten skal informeres om å oppsøke øyeblikkelig legehjelp ved tegn/symptomer på kardiovaskulær hendelse. Ved utvikling av alvorlig kardiovaskulær hendelse bør behandlingen seponeres inntil den akutte hendelsen er stabilisert. Helmintinfeksjon bør behandles før behandlingsoppstart. Hvis pasienten smittes under behandling og ikke responderer på antihelmintika, skal Tezspire seponeres til infeksjonen går over. Levende, svekkede vaksiner skal unngås. Graviditet og amming: Bruk under graviditet bør unngås med mindre forventet nytte for den gravide oppveier mulig risiko for fosteret. Risiko for nyfødte som ammes de første dagene etter fødsel kan ikke utelukkes. Basert på fordel av amming for barnet/fordel av behandling for mor må det tas en beslutning om Tezspire skal avsluttes/avstås fra i denne perioden.
Pakninger og priser: Injeksjonsvæske, oppløsning i ferdigfylt penn (210 mg): 1 stk: kr. : 15 053,40 Injeksjonsvæske, oppløsning i ferdigfylt sprøyte (210 mg): 1 stk. kr. : 15 053,40
Reseptgruppe: C. Refusjon: H-resept.
Refusjonsberettiget bruk: Der det er utarbeidet nasjonale handlingsprogrammet/nasjonal faglig retningslinje og/eller anbefalinger fra RHF/LIS spesialistgruppe skal rekvirering gjøres i tråd med disse. Vilkår: 216 Refusjon ytes kun etter resept fra sykehuslege eller avtalespesialist.
Tezspire inngår i RHF anbefalinger for alvorlig ukontrollert T2-høy astma. For legemidlene under skal denne rangering legges til grunn.
Voksne > 18 år:
1.valg: Fasenra (benralizumab) AstraZeneca AS
2.valg: Tezspire (tezepelumab) AstraZeneca AS
3.valg: Nucala((mepolizumab) GlaxoSmithKline AS
4.valg: Dupixent (dupilumab) Sanofi-Aventis Norge AS
Ungdom: 12-18 år
1.valg: Tezspire (tezepelumab) AstraZeneca AS
2.valg: Nucala (mepolizumab) GlaxoSmithKline AS
3.valg: Dupixent (dupilumab) Sanofi-Aventis Norge AS
Rangeringen skal følges ved oppstart og endring av behandling.
Dersom pasienten av medisinske årsaker ikke kan bruke den rimeligste behandlingen, skal disse årsakene dokumenteres i pasientens journal. Komorbiditet skal i utgangspunktet ikke tillegges vekt ved valg av medikament. Vedtaket gjelder i perioden 01.09.2024- 31.03.2026
Beslutning i Beslutningsforum for nye metoder 18.03.2024.
Tezepelumab (Tezspire) innføres som tillegg til vedlikeholdsbehandling ved alvorlig astma med eosinofili hos voksne og ungdom i alderen 12 år og eldre som er utilstrekkelig kontrollert til tross for høye doser inhalasjonskortikosteroider i tillegg til et annet legemiddel for vedlikeholdsbehandling.
For fullstendig informasjon, les TEZSPIRE SPC på www.felleskatalogen.no
NO-12883-09-2024-TEZ
Indikasjon:
Astma: Fasenra er indisert som tillegg til vedlikeholdsbehandling hos voksne med alvorlig eosinofil astma som er utilstrekkelig kontrollert til tross for høye doser inhalasjonskortikosteroider samt langtidsvirkende beta-agonister.
Eosinofil granulomatose med polyangiitt (EGPA): Fasenra er indisert som tilleggsbehandling hos voksne pasienter med relapserende eller refraktær eosinofil granulomatose med polyangiitt.
Dosering: Fasenra er beregnet til langtidsbehandling. Behovet for fortsatt behandling bør vurderes minst én gang årlig, basert på sykdommens alvorlighetsgrad, graden av sykdomskontroll og eosinofiltall i blod.
Astma: Anbefalt dose er 30 mg som subkutan injeksjon hver 4. uke for de første 3 dosene, og deretter hver 8. uke. Behandlingen skal startes opp av lege med erfaring med diagnostisering og behandling av alvorlig astma.
EGPA: Anbefalt dose er 30 mg som subkutan injeksjon hver 4. uke. Hos pasienter som utvikler livstruende manifestasjoner av EGPA, skal behovet for fortsatt behandling vurderes, siden Fasenra ikke har blitt undersøkt i denne populasjonen.
Manglende dose: Dersom en injeksjon uteblir på en planlagt dato, skal doseringen gjenopptas så snart som mulig etter angitt behandlingsregime. En dobbelt dose skal ikke administreres.
Kontraindikasjoner: Overfølsomhet overfor virkestoffet eller overfor noen av hjelpestoffene.
Vanlige bivirkninger: Feber, reaksjon på injeksjonsstedet, overfølsomhetsreaksjon, faryngitt, hodepine.
Ukjent frekvens: Anafylaktisk reaksjon.
Forsiktighetsregler: Skal ikke brukes ved akutt forverring av astma. Pasienten bør instrueres om å søke medisinsk hjelp dersom astmaen forblir ukontrollert eller forverres. Brå seponering av kortikosteroider etter behandlingsoppstart anbefales ikke. Hvis reduksjon i kortikosteroiddose er nødvendig, bør dette skje gradvis og veiledet av lege. Overfølsomhetsreaksjon/anafylaktisk reaksjon: Kan oppstå innen timer eller dager etter injeksjonen. Anamnese med anafylaksi (ikke relatert til benralizumab) kan være en risikofaktor.
Pasienten bør overvåkes over en hensiktsmessig tidsperiode etter administreringen, og preparatet seponeres permanent og hensiktsmessig behandling iverksettes dersom overfølsomhetsreaksjoner oppstår. Parasittære infeksjoner (helmint): Preeksisterende helmintinfeksjoner bør behandles før oppstart av benralizumab. Dersom pasienten blir infisert under behandling og ikke responderer på antihelmintika, bør behandling med benralizumab seponeres inntil infeksjonen er bekjempet. Bruk bør unngås under graviditet og amming. Fasenra har ikke blitt undersøkt hos pasienter med aktive organtruende eller livstruende manifestasjoner av EGPA.
Pakninger og priser: Injeksjonsvæske, oppløsning i ferdigfylt penn (30 mg): 1 stk. kr 34065,90.
Injeksjonsvæske, oppløsning i ferdigfylt sprøyte (30 mg): 1 stk. kr 34065,90.
Reseptgruppe: C. Refusjon: H-resept.
Refusjonsberettiget bruk: Der det er utarbeidet nasjonale handlingsprogrammet/nasjonal faglig retningslinje og/eller anbefalinger fra RHF/LIS spesialistgruppe skal rekvirering gjøres i tråd med disse. Vilkår: 216 Refusjon ytes kun etter resept fra sykehuslege eller avtalespesialist. Fasenra inngår i RHF anbefalinger for alvorlig ukontrollert T2-høy astma. For legemidlene under skal denne rangering legges til grunn.
Voksne > 18 år
1. valg: Fasenra (benralizumab) AstraZeneca AS
2. valg: Tezspire (tezepelumab) AstraZeneca AS
3. valg: Nucala (mepolizumab) GlaxoSmithKline AS
4. valg: Dupixent (dupilumab) Sanofi-Aventis Norge AS
Rangeringen skal følges ved oppstart og endring av behandling. Dersom pasienten av medisinske årsaker ikke kan bruke den rimeligste behandlingen, skal disse årsakene dokumenteres i pasientens journal. Komorbiditet skal i utgangspunktet ikke tillegges vekt ved valg av medikament. Vedtaket gjelder i perioden 01.09.2024- 31.03.2026.
AstraZeneca AS - www.astrazeneca.no – P. box 6050 Etterstad - 0601 Oslo
NO-13291-11-2024-FA
Les mer om TEZSPIRE (tezepelumab) på felleskatalogen.no
Les mer om Symbicort forte Turbuhaler på felleskatalogen.no
Les mer om Symbicort Inhalasjonsaerosol på felleskatalogen.no
Les mer om Symbicort mite Turbuhaler på felleskatalogen.no
Busse WW. Biological treatments for severe asthma: a major advance in asthma care. Allergol Int 2019;68:158-66.
Tran TN, Zeiger RS, Peters SP, et al. Overlap of atopic, eosinophilic, and TH2 high asthma phenotypes in a general population wi th current asthma. Ann Allergy Asthma Immunol 2016;116:37-42.
Kupczyk M, Dahlén B, Sterk PJ, et al; the BIOAIR investigators. Stability of phenotypes defined by physiological variables and biomarkers in adults with asthma. Euro JACI 2014;69:1198-1204.
Denton E, Price DB, Tran TN et al. Cluster Analysis of Inflammatory Biomarker Expression in the International Severe Asthma Registry J Allergy Clin Immunol Pract 2021;9:2680–8.
LIS-2016 Biologiske legemidler mot alvorlig astma T2-høy. Sist oppdatert 1. september 2024. sykehusinnkjøp.no/avtaler-legemidler/alvorlig-astma (sjekket sep 2024).
Menzies-Gow A, Wechsler ME, Brightling CE. Unmet need in severe, uncontrolled asthma: can anti-TSLP therapy with tezepelumab provide a valuable new treatment option? Respir Res 2020;21:268.
Gauvreau GM, Sehmi R, Ambrose CS et al. Thymic stromal lymphopoietin: its role and potential as a therapeutic target in asthma. Expert Opin Ther Targets 2020;24:777–92.
Diver S, Khalfaoui L, Emson C, et al; CASCADE study investigators. Effect of tezepelumab on airway inflammatory cells, remodelling, and hyperresponsiveness in patients with moderate-to-severe uncontrolled asthma (CASCADE): a double-blind, randomised, placebo-controlled, phase 2 trial. Lancet Respir Med 2021;9:1299-1312.
Sverrild A, Hansen S; Hvidtfeldt M et al . The effect of tezepelumab on airway hyperresponsiveness to mannitol in asthma (UPSTREAM) Eur Respir J 2021;59:2101296.
Heaney LG, de Llano LP, Al-Ahmad M et al. Eosinophilic and Noneosinophilic Asthma. Chest 2021;160:814-30.
Korn S, Bourdin A, Chupp G et al Integrated Safety and Efficacy Among Patients Receiving Benralizumab for Up to 5 Years. JACI Pract 2021;9:4381-92.
Nair P, Wenzel S, Rabe K et al. Oral Glucocorticoid–Sparing Effect of Benralizumab in Severe Asthma. N Engl J Med 2017;376:2448-58.
Menzies-Gow A, Gurnell M, Heaney LG et al. Adrenal function recovery after durable OCS- sparing with benralizumab in the PONENTE study.Eur Respir J 2022;60:2103226.
Menzies-Gow A, Gurnell M, Heaney LG et al, Oral corticosteroid elimination via a personalised reduction algorithm in adults with severe, eosinophilic asthma treated with benralizumab (PONENTE): a multicentre, open-label, single-arm study. Lancet Resp Med 2021;10:47-58.
Jackson DJ, Burhan H, Menzies-Gow A et al. Benralizumab Effectiveness in Severe Asthma Is Independent of Previous Biologic Use. JACI Pract 2022;10:1534-44.
McBrien CN, Menzies-Gow A. The Biology of eosinophils and Their Role in Asthma. Front Med 2017;4:1-14.
Fasenra SPC 4.1, 4.2, 4.8, 5.1.
Tezspire SPC 4, 5.1.
NO-12542-08-2024-FA