Viktig informasjon Lynparza
LYNPARZA®(olaparib) er en potent hemmer av humane poly (ADP-ribose) polymerase (PARP-1, PARP-2 og PARP-3)-enzymer. Hemmer veksten av selekterte tumorcellelinjer in vitro og tumorvekst in vivo, enten som eneste behandling eller i kombinasjon med etablerte kjemoterapier.
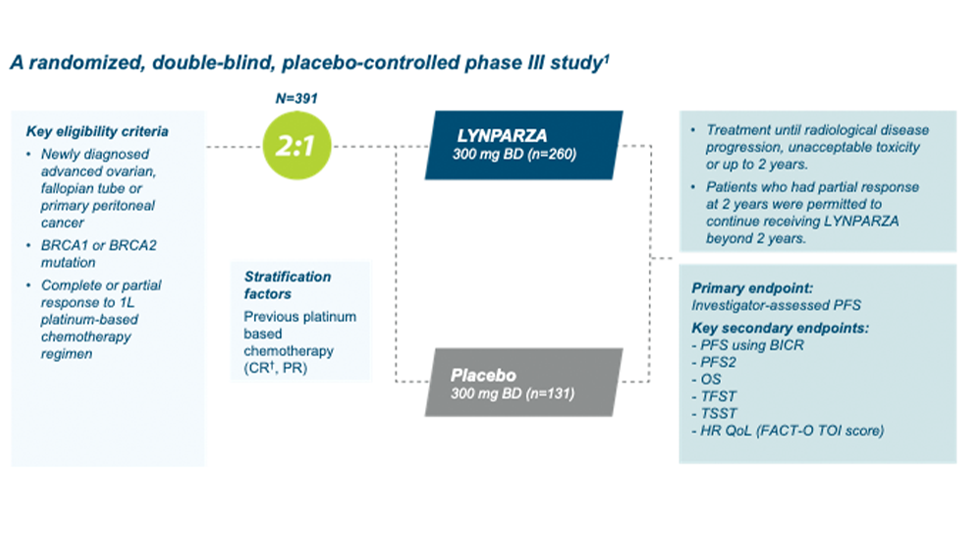
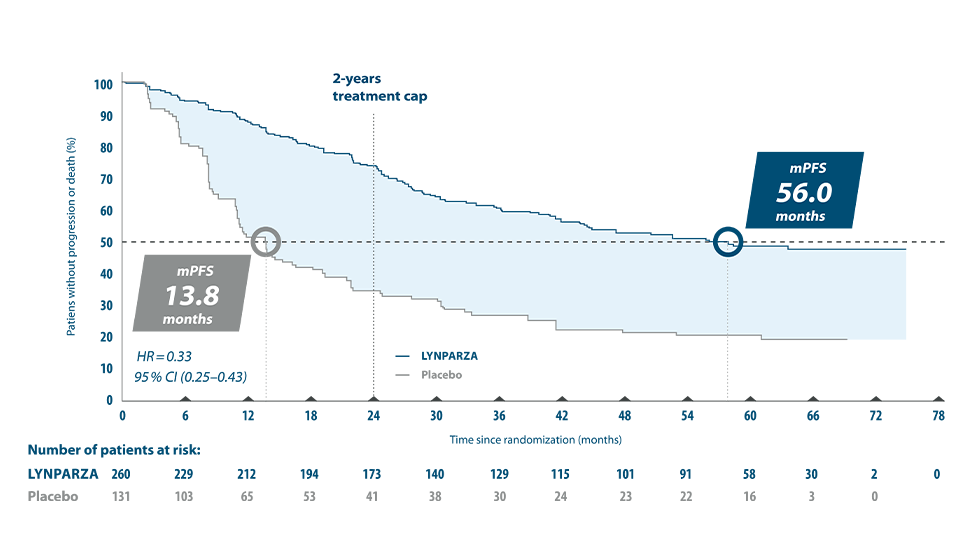
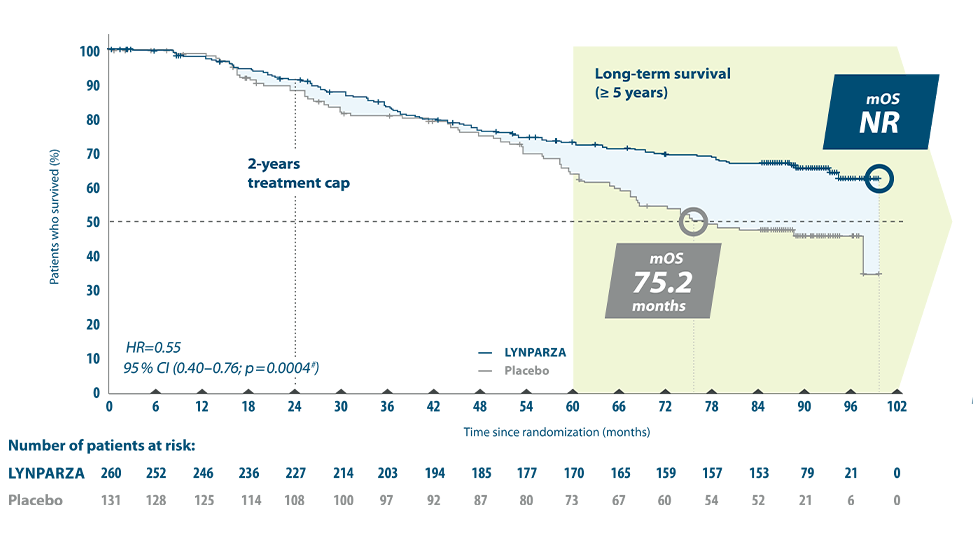
Ovarialkreft: Lynparza er indisert som monoterapi til: Vedlikeholdsbehandling av voksne pasienter med avansert (FIGO trinn III og IV) BRCA1/2- mutert (kimbanen og/eller somatisk) høygradig kreft i ovarieepitel, eggleder eller primær peritoneal kreft som responderer (fullstendig eller delvis) etter avsluttet førstelinje platinabasert kjemoterapi. Vedlikeholdsbehandling av voksne pasienter med tilbakefall av platinasensitiv høygradig kreft i ovarieepitel eller eggleder eller primær peritoneal kreft som responderer (fullstendig eller delvis) på platinabasert kjemoterapi.
Lynparza i kombinasjon med bevacizumab er indisert til: Vedlikeholdsbehandling av voksne pasienter med avansert (FIGO trinn III og IV) høygradig kreft i ovarieepitel, eggleder eller primær peritoneal kreft som responderer (fullstendig eller delvis) etter avsluttet førstelinje platinabasert kjemoterapi i kombinasjon med bevacizumab, og hvor kreften er forbundet med defekt homolog rekombinasjon (HRD)-positiv status definert av enten en BRCA1/2 mutasjon og/eller genomisk ustabilitet, (se pkt. 5.1 i SPC).
DOSERING OG ADMINISTRASJONSMÅTE. Behandling med Lynparza bør initieres og overvåkes av lege med erfaring i bruk av legemidler til kreftbehandling. Anbefalt dose av Lynparza som monoterapi eller i kombinasjon med bevacizumab for ovarialkreft er 300 mg (to tabletter à 150 mg) som skal tas to ganger daglig, tilsvarende en daglig dose på totalt 600 mg. Tablett à 100 mg er tilgjengelig for dosereduksjon. Ved bruk av Lynparza i kombinasjon med bevacizumab til behandling av pasienter med høygradig kreft i ovarieepitel, eggleder eller primær peritoneal kreft er dosen med bevacizumab 15 mg/kg én gang hver 3. uke. Vennligst se fullstendig produktinformasjon for bevacizumab (se pkt. 5.1 i SPC).
KONTRAINDIKASJONER: Amming under behandling og i 1 måned etter den siste dosen (se pkt. 4.6 i SPC).
FORSIKTIGHET UTVISES VED:
Hematologisk toksisitet: Blodtelling før behandlingsoppstart og deretter månedlig, er anbefalt de første 12 månedene av behandlingen og periodevis etter dette tidspunktet for å overvåke klinisk signifikante endringer av verdiene under behandling.
Myelodysplastisk syndrom/akutt myelogen leukemi: Dersom MDS og/eller AML blir diagnostisert under behandling med Lynparza, skal Lynparza seponeres og pasienten skal få hensiktsmessig behandling.
Venøse tromboemboliske hendelser: Pasientene skal overvåkes med tanke på kliniske tegn og symptomer på venetrombose og lungemboli og behandles på medisinsk hensiktsmessig måte.
Pneumonitt: Hvis pasienten får nye, eller en forverring av respiratoriske symptomer som dyspné, hoste og feber, eller et unormalt radiologisk funn observeres i brystet, bør behandling med Lynparza avbrytes og utredning igangsettes raskt.
Levertoksisitet: Dersom det utvikles kliniske symptomer eller tegn som tyder på levertoksisitet, må klinisk vurdering av pasienten og måling av leverfunksjonsprøver utføres raskt. Dersom det mistenkes legemiddelutløst leverskade (DILI), skal behandlingen avbrytes.
Fertilitet, graviditet: Fertile kvinner må ikke bli gravide når Lynparza benyttes og må ikke være gravide ved oppstart av behandlingen. Graviditetstesting bør utføres før oppstart av behandling og deretter regelmessig under behandling på alle fertile kvinner. Effekten av noen hormonelle legemidler kan reduseres ved samtidig administrasjon med Lynparza. En ekstra ikke-hormonell prevensjonsmetode bør derfor vurderes under behandling. Fertile kvinner må bruke to former for sikker prevensjon før oppstart av behandling med Lynparza, under behandlingen og i 6 måneder etter siste dose med Lynparza. Mannlige pasienter må bruke kondom og deres fertile kvinnelige partnere skal bruke sikker prevensjon under behandling og i 3 måneder etter å ha fått siste dose av Lynparza (se pkt. 4.6 i SPC).
VIKTIGE INTERAKSJONER: Samtidig administrering av Lynparza med kraftige eller moderate CYP3A-hemmere eller CYP3A-induktorer anbefales ikke. Se pkt. 4.2 og 4.5 i SPC for mer informasjon dersom en kraftig eller moderat CYP3A-hemmer eller CYP3A-induktor likevel må administreres samtidig med Lynparza.
VIKTIGE BIVIRKNINGER: De hyppigste observerte bivirkningene på tvers av kliniske studier hos pasienter som fikk Lynparza som monoterapi (≥ 10 %) var kvalme, oppkast, diaré, dyspepsi, fatigue/asteni, hodepine, dysgeusi, nedsatt appetitt, svimmelhet, hoste, dyspné, anemi, nøytropeni, , og leukocytopeni.
PRIS, FINANSIERING OG FORSKRIVNINGSREGLER
Pakninger og priser: Tabletter: 100 mg: 56 stk. kr 27754,60. 150 mg: 56 stk. kr 27754,60. Reseptgruppe C. H-resept.
Lynparza inngår i de regionale helseforetakenes anbefalinger for onkologiske legemidler, og rekvirering skal gjøres i tråd med disse: https://www.sykehusinnkjop.no/avtaler-legemidler/onkologi/.
Markedsføringsinnehaver: AstraZeneca AS, Karvesvingen 7, 0579 Oslo, tel. 21006400
Før forskrivning av LYNPARZA, se FK-tekst eller SPC på www.felleskatalogen.no
AstraZeneca and MSD have an alliance regarding the product Lynparza.
NO-13233-11-24-ONC